Trang thiết bị y tế (TTBYT) là một loại hàng hóa đặc thù được quản lý bởi Bộ Y tế, có ảnh hưởng trực tiếp đến sức khỏe, tính mạng người sử dụng và những người xung quanh. Trong đại dịch Covid-19, nhu cầu sản xuất TTBYT càng tăng cao, nhiều cơ sở thuộc ngành nghề khác cũng mở rộng sản xuất TTBYT để đáp ứng nhu cầu xã hội. Vậy những cơ sở này cần tuân thủ những quy định nào?
1. Văn bản điều chỉnh hoạt động sản xuất TTBYT
Nghị định 36/2016/NĐ-CP của Chính phủ về Quản lý trang thiết bị y tế quy định gần như toàn bộ các vấn đề có liên quan trong sản xuất TTBYT. Nghị định này được sửa đổi, bổ sung năm 2018 bằng Nghị định 169/20218/NĐ-CP và Nghị định 03/2020/NĐ-CP.
Ngoài ra, quy định về nhãn của TTBYT khi đăng ký với cơ quan quản lý được thực hiện theo Nghị định 43/2017/NĐ-CP của Chính phủ về Nhãn hàng hóa.
Hướng dẫn cho Nghị định 36 là Thông tư 46/2017/TT-BYT và Thông tư 39/2016/TT-BYT quy định chi tiết việc phân loại trang thiết bị y tế do Bộ trưởng Bộ y tế ban hành
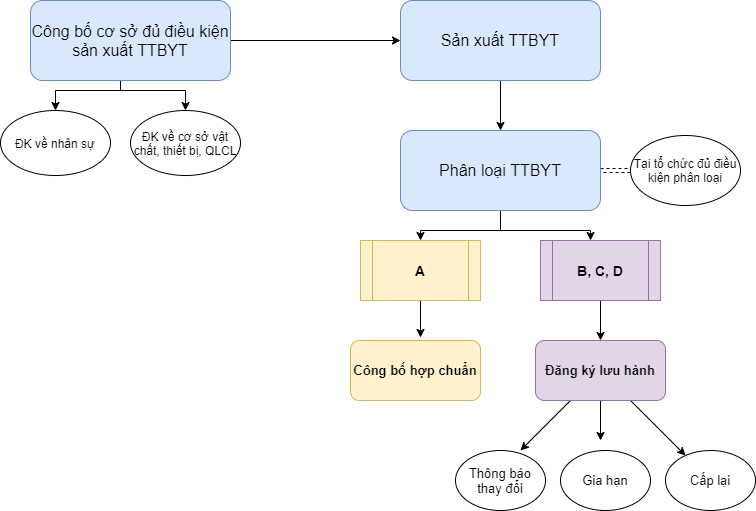
2. Công bố cơ sở đủ điều kiện sản xuất TTBYT
Bước đầu tiên trong quy trình là Công bố cơ sở đủ điều kiện sản xuất TTBYT.
Theo Khoản 7 Điều 1 Nghị định 169/2018/NĐ-CP, trước khi thực hiện sản xuất trang thiết bị y tế, người đứng đầu cơ sở sản xuất có trách nhiệm gửi hồ sơ công bố đủ điều kiện sản xuất tại Sở Y tế nơi cơ sở sản xuất đặt trụ sở. Trường hợp cơ sở công bố sản xuất trang thiết bị y tế có chứa chất ma túy và tiền chất thì Sở Y tế có trách nhiệm gửi bản sao Phiếu tiếp nhận hồ sơ công bố đủ điều kiện sản xuất cho Bộ Công an.
Hồ sơ công bố được quy định tại Điều 16 Nghị định 36/2016/NĐ-CP. Sau khi nhận phiếu tiếp nhận, cơ sở có thể bắt đầu tiến hành sản xuất.
3. Phân loại TTBYT
Điều 4 Nghị định 36/2016/NĐ-CP quy định TTBYT được phân loại như sau:
– Nhóm 1 gồm trang thiết bị y tế thuộc loại A là trang thiết bị y tế có mức độ rủi ro thấp.
– Nhóm 2 gồm trang thiết bị y tế thuộc loại B, C và D, trong đó:
a) Trang thiết bị y tế thuộc loại B là trang thiết bị y tế có mức độ rủi ro trung bình thấp;
b) Trang thiết bị y tế thuộc loại C là trang thiết bị y tế có mức độ rủi ro trung bình cao;
c) Trang thiết bị y tế thuộc loại D là trang thiết bị y tế có mức độ rủi ro cao.
Việc phân loại trang thiết bị y tế phải do tổ chức đủ điều kiện và được cấp phép theo Nghị định này thực hiện.
4. Công bố tiêu chuẩn áp dụng
Với TTBYT thuộc loại A, cơ sở sản xuất phải thực hiện thủ tục Công bố tiêu chuẩn áp dụng tại Sở Y tế nơi cơ sở đặt trụ sở. Hồ sơ được quy định tại Điều 22 gồm có:
- Văn bản công bố tiêu chuẩn áp dụng của TTBYT
- Bản phân loại TTBYT
- Giấy chứng nhận đạt tiêu chuẩn quản lý chất lượng còn hiệu lực
- Phiếu tiếp nhận hồ sơ công bố đủ điều kiện sản xuất TTBYT
- Giấy ủy quyền của chủ sở hữu TTBYT cho tổ chức đứng tên công bố tiêu chuẩn
- Giấy xác nhận đủ điều kiện bảo hành
- Tài liệu mô tả tóm tắt kỹ thuật TTBYT
- Giấy chứng nhận hợp chuẩn theo quy định hoặc bản tiêu chuẩn sản phẩm
- Tài liệu hướng dẫn sử dụng của TTBYT
- Mẫu nhãn sẽ sử dụng khi lưu hành tại Việt Nam của TTBYT.
TTBYT thuộc loại A chỉ được lưu hành trên thị trường sau khi đã được Sở Y tế cấp phiếu tiếp nhận hồ sơ công bố tiêu chuẩn.
5. Đăng ký lưu hành
Đối với TTBYT loại B, C, D, cơ sở sản xuất cần thực hiện thủ tục đăng ký lưu hành tại Bộ Y tế. Hồ sơ cấp mới số lưu hành của TTBYT được chia làm 03 loại:
- Đối với trang thiết bị y tế chưa có quy chuẩn kỹ thuật quốc gia tương ứng
- Văn bản đề nghị cấp mới số lưu hành của TTBYT
- Bản phân loại TTBYT
- Giấy chứng nhận đạt tiêu chuẩn quản lý chất lượng còn hiệu lực
- Phiếu tiếp nhận hồ sơ công bố đủ điều kiện sản xuất TTBYT
- Giấy ủy quyền của chủ sở hữu TTBYT cho tổ chức đứng tên đăng ký lưu hành
- Giấy xác nhận đủ điều kiện bảo hành
- Tài liệu mô tả tóm tắt kỹ thuật TTBYT
- Hồ sơ kỹ thuật chung thực hiện theo hướng dẫn tại Hiệp định ASEAN về TTBYT
- Tài liệu hướng dẫn sử dụng của TTBYT
- Mẫu nhãn sẽ sử dụng khi lưu hành tại Việt Nam của TTBYT.
- Bản tóm tắt dữ liệu thử lâm sàng, Giấy chứng nhận kiểm định, Báo cáo kết quả hoạt động kinh doanh trong thời hạn được cấp số lưu hành (trong những trường hợp cụ thể).
- Đối với trang thiết bị y tế đã có quy chuẩn kỹ thuật quốc gia tương ứng
Các giấy tờ như mục trên và nộp thêm Giấy chứng nhận hợp quy;
- Đối với trang thiết bị y tế là phương tiện đo phải phê duyệt mẫu theo quy định của pháp luật về đo lường
Các giấy tờ như mục trên và nộp thêm Quyết định phê duyệt mẫu;
Số lưu hành của TTBYT thuộc loại B, C, D có giá trị 05 năm, kể từ ngày cấp. Cơ sở sản xuất cần gia hạn số lưu hành. Trường hợp TTBYT được gia hạn số lưu hành thì vẫn giữ nguyên số lưu hành đã được cấp trước đó.
Ngoài ra, trong quá trình lưu hành TTBYT, chủ sở hữu số lưu hành có trách nhiệm gửi văn bản thông báo cho Bộ Y tế trong thời hạn 10 ngày làm việc, kể từ ngày có một trong các thay đổi quy định tại Khoản 8 Điều 29 Nghị định 36/2016/NĐ-CP.








